 |
| Temas de FC |
A. Gimeno Díaz de Atauri*, R. Morante Valverde**
*Sección de Neumología y Alergia Infantil. Servicio de Pediatría. Hospital Universitario 12 de Octubre. Madrid. **Servicio de Cirugía Pediátrica. Hospital Universitario 12 de Octubre. Madrid
| Resumen
La patología pleural en el niño requiere de atención especializada hospitalaria, en la mayor parte de los casos. Las afecciones más frecuentes en niños son el derrame pleural (DP) y el neumotórax. |
| Abstract
Pleural pathology in the child requires specialized hospital care in most cases. The most common conditions in children are pleural effusion (PE) and pneumothorax. |
Palabras clave: Pleura; Derrame; Neumotórax.
Key words: Pleura; Effusion; Pneumothorax.
Pediatr Integral 2021; XXV (1): 29 – 36
Patología pleural: derrame, neumotórax y neumomediastino
Derrame pleural
Introducción
El derrame pleural es el acúmulo de un exceso de líquido en el espacio pleural. La causa más frecuente en Pediatría es la neumonía (derrame paraneumónico).
Los pulmones están recubiertos por dos capas de membranas semipermeables (pleura): una queda en contacto con el pulmón (capa visceral) y la otra con la caja torácica (capa parietal). Entre ambas queda el espacio pleural donde, en condiciones normales, hay unos 0,3 ml de ultrafiltrado del plasma, procedente de los capilares de la pleura parietal y que es drenado por el sistema linfático(1). El derrame pleural (DP) consiste en el acúmulo de un exceso de líquido, como consecuencia de un desequilibrio entre la producción y el drenaje del mismo. Puede ser de dos tipos, dependiendo de las características del fluido: trasudados o exudados. Los trasudados son transparentes, de color ambarino y se deben fundamentalmente a alteraciones en la presión oncótica o hidrostática en la red capilar pulmonar. En los exudados, el líquido es más turbio y espeso, y la causa suele estar relacionada con procesos inflamatorios o con problemas del drenaje linfático. El DP más frecuente en los niños previamente sanos, es el secundario a un proceso neumónico agudo (derrame paraneumónico [DPN]), por lo que la mayor parte de este artículo se centrará en esta patología. Existen otros dos tipos de derrame con nombre propio: hemotórax, que es el acúmulo de sangre en el espacio pleural y que generalmente está relacionado con traumatismos; y quilotórax, en el que el espacio pleural se llena de líquido linfático. La causa más frecuente de quilotórax es la secundaria a traumatismo del conducto torácico, principalmente en relación con procesos quirúrgicos cervicales o cardiotorácicos. Otras posibles causas incluyen: trombosis de la vena cava superior, tumores sólidos o enfermedades granulomatosas. El quilotórax congénito es una causa poco frecuente de DP en niños, aunque es la causa más frecuente de DP en el periodo neonatal. Se asocia a: malformaciones congénitas linfáticas, hydrops fetalis y a algunos síndromes concretos, como: síndrome de Down, síndrome de Noonan o síndrome de Turner(2,3).
Epidemiología
Actualmente, la incidencia anual en nuestro medio del derrame paraneumónico es de unos 2 por cada 100.000 niños. La epidemiología del derrame no paraneumónico está poco estudiada.
Existen pocos datos fiables sobre la epidemiología del DP en niños. En cuanto al DPN, los datos varían según los países y han sido muy variables a lo largo del tiempo en función del estado vacunal de la población para H. influenzae y, sobre todo, para neumococo, con un descenso importante de los ingresos por este motivo tras la introducción de la vacuna antineumocócica 13 valente. Se estima que, actualmente, la incidencia anual de empiema en nuestro entorno es de, aproximadamente, 2 por cada 100.000 niños(4,5).
Fisiopatología
El derrame pleural está causado por un desequilibrio entre la producción y la evacuación del líquido pleural. Los procesos inflamatorios son la principal causa en Pediatría.
El DP está causado por un desequilibrio entre la evacuación y la producción del líquido pleural, aunque el exceso de producción es más frecuente. El mecanismo de aparición del DP pasa por el aumento de la permeabilidad de la membrana pleural (procesos infecciosos, inflamatorios o tumorales) o la aparición de cambios en la red capilar, como aumento de la presión hidrostática (insuficiencia cardiaca congestiva, sobrecarga de volumen) o descenso de la presión oncótica (hipoproteinemia). También puede ocurrir, si hay paso de líquido desde el peritoneo o por una presión negativa intratorácica importante como, por ejemplo, en las atelectasias masivas(6). Las causas más frecuentes de DP quedan resumidas en la tabla I.
En el caso concreto de los DPN, la infección produce una inflamación pleural (pleuritis seca) que desencadena un aumento de la permeabilidad (fase exudativa) y, posteriormente, una fase fibropurulenta que pude dar lugar a una fase organizativa con formación de tractos fibrosos en el espacio pleural(7).
Clínica
Los síntomas dependen de la cantidad y rapidez de instauración del derrame. Los más frecuentes son: dificultad respiratoria, tos y dolor torácico.
Los pacientes pueden estar asintomáticos o presentar: disnea, empleo de la musculatura respiratoria accesoria, taquipnea, tos o/y dolor torácico en función de las características, la velocidad de instauración y la cantidad del DP. En el caso del DPN, suele haber fiebre asociada y más afectación del estado general que en los niños con neumonía sin derrame. También debe sospecharse, cuando una neumonía no mejora clínicamente tras 48 horas de tratamiento antibiótico apropiado. En la exploración física, destaca la disminución del murmullo vesicular y matidez a la percusión. En los derrames unilaterales grandes, puede haber disminución de la expansión torácica en el lado afecto(6-8).
Diagnóstico y diagnóstico diferencial
Para el diagnóstico, son fundamentales la radiografía y la ecografía torácicas. En algunos casos, es necesario realizar toracocentesis para estudiar el líquido pleural.
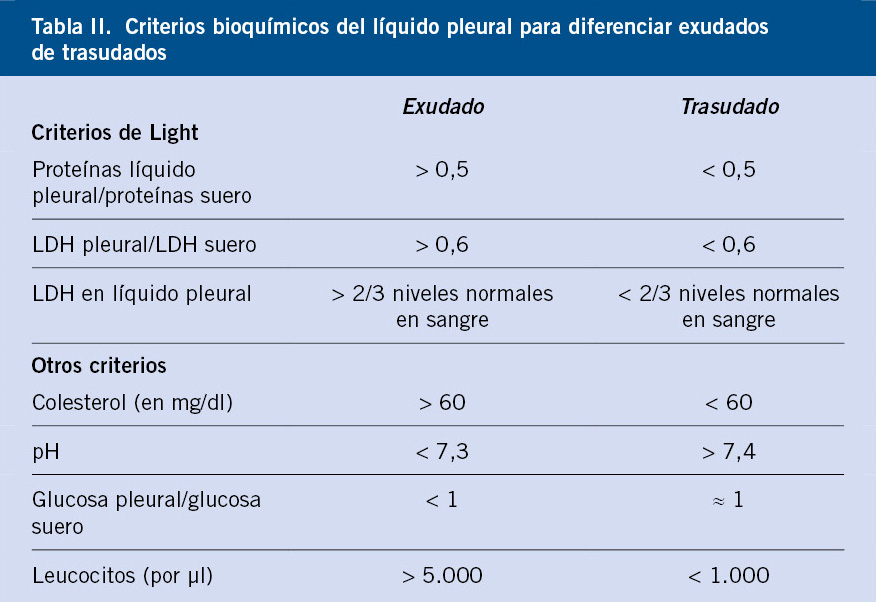
Ante la sospecha clínica de DP, la prueba inicial más accesible es la radiografía simple de tórax que, en la proyección anteroposterior, típicamente muestra la ocupación del seno costo-frénico afectado y, cuando el derrame va aumentando, una imagen homogénea de condensación con borde superior cóncavo y con mayor elevación en contacto con la pared torácica (curva de Damoisseau) (Fig. 1).
Figura 1. Radiografía posteroanterior de tórax con derrame pleural paraneumónico.
Si el paciente está en decúbito supino, como suele ocurrir en los lactantes, este signo puede pasar desapercibido y el DP se manifiesta como un aumento homogéneo de la densidad del hemitórax afecto, engrosamiento de las cisuras y aparición de una línea pleural en la zona más externa, en paralelo a la línea de inflexión de los arcos costales. También puede aparecer escoliosis con concavidad hacia el lado afecto. El derrame masivo puede provocar la opacificación completa del hemitórax y desplazamiento mediastínico hacia el lado contrario. La radiografía en decúbito lateral sobre el lado patológico, puede ayudar a identificar pequeñas cantidades de derrame libre. Generalmente, se considera que si la altura del derrame en esta proyección es menor de 1 cm, las probabilidades de obtener líquido con una toracocentesis son mínimas. La ecografía de tórax (Fig. 2) en manos expertas, puede llegar a sustituir la radiografía simple y cada vez existen más publicaciones sobre su uso a pie de cama por el clínico que atiende al paciente en el diagnóstico de neumonía y DPN asociado.
Figura 2. Ecografía torácica que muestra derrame pleural anecoico y condensación parenquimatosa subyacente con broncograma aéreo.
Permite: confirmar el diagnóstico de DP, definir su tamaño y características, realizar un seguimiento evolutivo y ayudar a establecer el mejor punto para realizar una toracocentesis, en caso de que esté indicada. La tomografía axial computarizada (TAC) supone mucha radiación y no está indicada inicialmente en el proceso diagnóstico del DP; aunque, en casos concretos, puede servir para filiar adecuadamente la causa subyacente o planificar una intervención quirúrgica(9).
La toracocentesis diagnóstica debe realizarse en todos los casos de etiología no aclarada, siempre que la cuantía del derrame sea suficiente. La extracción debe hacerse con jeringa heparinizada y realizar el análisis bioquímico y de pH lo más rápido posible, para que los resultados sean fiables. Las características del líquido permiten diferenciar exudados de trasudados; los criterios más empleados son los descritos por Light en 1972, que tienen alta sensibilidad en adultos para reconocer un exudado cuando se cumple, al menos, uno de los tres criterios. Estos criterios y algunos descritos posteriormente, quedan reflejados en la tabla II y pueden ayudar a la toma de decisiones terapéuticas, aunque hay controversia al respecto, porque la evidencia en niños es muy escasa(10).
El análisis de otros datos bioquímicos puede aportar información importante, como la presencia de triglicéridos por encima de 110 mg/dl para el diagnóstico de quilotórax. La citología puede orientar el diagnóstico etiológico de enfermedades infecciosas e inflamatorias, y facilitar el diagnóstico de enfermedades neoplásicas. Se debe enviar muestra también, para estudio microbiológico.
Además, dentro de la batería inicial de pruebas diagnósticas, es necesario solicitar analítica de sangre que incluya, al menos: hemograma, proteína C reactiva, perfil hepatorrenal, proteínas totales y lactatodeshidrogenasa (LDH), así como hemocultivo, en los casos en los que se sospeche etiología infecciosa. Se valorará añadir otros estudios como: prueba de tuberculina, ecocardiografía, etc., en función de la sospecha diagnóstica.
Tratamiento
Las indicaciones de drenaje del derrame son fundamentalmente: la ausencia de respuesta al tratamiento de la enfermedad de base y el compromiso cardiorrespiratorio por un derrame muy cuantioso.
El manejo del DP en niños debe hacerse siempre con el paciente ingresado en el hospital y con el tratamiento de soporte necesario según la situación clínica. Por lo demás, en muchos casos, basta con el tratamiento adecuado de la causa subyacente. En DP muy cuantiosos, puede ser necesario realizar una toracocentesis terapéutica para facilitar la expansión pulmonar y disminuir la sintomatología cardiorrespiratoria. Hay que tener precaución en los casos con acúmulo muy importante de líquido pleural, especialmente los de larga evolución, ya que la expansión rápida del parénquima pulmonar y el relleno brusco del lecho vascular pulmonar, puede dar lugar a un cuadro de edema agudo de pulmón o/y de hipotensión arterial. El control del dolor debe ser una prioridad mientras se mantenga el drenaje, que debe ser hasta que el débito de líquido sea mínimo (<40-60 ml/día o menor de 1 ml/kg/día, según otros autores).
En el caso del DPN, cuando es pequeño y no complicado, puede tratarse exclusivamente con antibioterapia intravenosa. Empíricamente, se emplean los mismos fármacos que en la neumonía adquirida en la comunidad, aunque a dosis más elevadas, para alcanzar adecuadamente el espacio pleural(11). No hay consenso en las distintas guías, sobre las indicaciones de la inserción de un tubo de drenaje (toracostomía) en el DPN. Hay que planteárselo, cuando hay: afectación clínica importante, tabiques u otros datos ecográficos de derrame complicado, ausencia de respuesta a antibioterapia intravenosa o tamaño importante del derrame (los puntos de corte a este respecto son arbitrarios y varían en las distintas publicaciones, desde 1 cm de espesor en algunas de ellas, a otras que sugieren que la mayor parte de los derrames que ocupen menos de la mitad del hemitórax, pueden resolverse con tratamiento conservador sin aumentar las complicaciones ni el tiempo de hospitalización). También se han propuesto criterios en función de las características del líquido pleural (pus franco, PH<7,2, glucosa <50 mg/dl, LDH >1.000 UI), aunque hay mucha controversia al respecto, por la falta de evidencia (a favor o en contra) en pacientes pediátricos(8,10-13).
La instilación de fibrinolíticos (urokinasa o estreptoquinasa) mejora el pronóstico frente al drenaje simple. Se administran cada 12 h durante 3 días, a través del tubo de drenaje, con cambios posturales y el tubo pinzado durante las 4 horas siguientes a la administración. Su uso está contraindicado en caso de alteraciones de la coagulación y cuando existen fístulas broncopleurales. Una alternativa a este procedimiento, es la videotorascocopia o cirugía toracoscópica asistida por vídeo (VATS, por sus siglas en inglés), que permite desbridar los tractos fibrosos y acceder a las loculaciones mediante visión directa. En los ensayos clínicos disponibles hasta el momento, sus resultados clínicos han sido similares a los obtenidos con un tubo de drenaje y fibrinolíticos, aunque puede conllevar un aumento de los costes. La experiencia del equipo quirúrgico de cada centro, es una variable fundamental a la hora de elegir entre ambas intervenciones. En todo caso, la ausencia de mejoría tras 48-72 horas de empleo de fibrinolíticos o la presencia de fístula broncopleural, son indicaciones de VATS(14,15). La decorticación mediante toracotomía posterolateral, permite eliminar el tejido fibroso y extraer todo el pus del espacio pleural, pero es una técnica más invasiva y está indicada solo en caso de fracaso de las demás opciones terapéuticas. En ocasiones, en caso de derrame recurrente, es necesario valorar una pleurodesis, que consiste en la fusión de ambas capas pleurales mediante la administración de sustancias esclerosantes a través de un tubo de tórax, o la abrasión pleural mecánica por toracoscopia o toracotomía.
Neumotórax
Introducción
El neumotórax consiste en un acúmulo de aire entre la pleura parietal y la visceral, y puede ser espontáneo o traumático.
El neumotórax traumático puede producirse por: explosión, quemadura, traumatismo torácico penetrante o por lesión iatrogénica (durante un procedimiento diagnóstico o terapéutico o secundario al barotrauma, asociado a ventilación mecánica). Este artículo se centra más en el neumotórax espontáneo (NE), que es aquel que se produce sin evidencia de traumatismo previo. Puede ser de dos tipos:
• Primario: es el más frecuente en niños y ocurre en pacientes sin patología pulmonar subyacente que predisponga a la fuga de aire.
• Secundario: aparece en pacientes con alguna patología pulmonar como: asma, fibrosis quística, neumonía necrotizante, bullas pulmonares o neumopatías intersticiales.
Epidemiología
La incidencia de neumotórax espontáneo varía según las series, siendo de 7,4 a 18 casos / 100.000 en varones y de 1,2 a 6 casos / 100.000 en mujeres, con un pico de incidencia en la adolescencia(16).
Fuera de esta edad, es frecuente encontrar neumotórax pequeños y asintomáticos en el periodo neonatal, apareciendo hasta en un 1-2% de los recién nacidos vivos. Por otro lado, los neumotórax sintomáticos ocurren únicamente en aproximadamente 2 de cada 10.000 recién nacidos vivos. Esta cifra es mayor en pacientes con factores de riesgo, como prematuridad o patología pulmonar; fundamentalmente, enfermedad de membrana hialina y aspiración meconial(17,18).
El NE es de 3 a 6 veces más frecuente en varones que en mujeres. En niñas adolescentes, existe un tipo de neumotórax asociado a la menstruación llamado neumotórax catamenial. Habitualmente, se produce en reposo; aunque, en algunas ocasiones, existe historia de actividad física o traumatismo torácico asociado, que produce aumento de las presiones pulmonares y actúa como factor precipitante.
Fisiopatología
Aunque cualquier fuga de aire entre la pleura parietal y visceral puede causar neumotórax, el neumotórax espontáneo ocurre exclusivamente por rotura de la pleura visceral.
Existen varios mecanismos que pueden dar lugar a rotura de pleura visceral y, por tanto, a neumotórax.
• Aumento de la presión transpulmonar, que causa distensión alveolar y puede llegar a producir rotura de los mismos. En ocasiones, en la superficie alveolar aparecen bullas, cuya rotura se abre directamente al espacio pleural, produciendo neumotórax. En otras ocasiones, el aire se confina en el espacio intersticial produciendo enfisema en esta localización y que también puede romperse al espacio pleural, si la presión es lo suficientemente alta. Si la rotura es del intersticio de la zona hiliar, el aire puede discurrir por el espacio perivascular y dar lugar a neumomediastino.
• Defectos en la pleura visceral, debido a alguna patología pulmonar. Esto ocurre en los neumotórax secundarios, como en los asociados a: procesos infecciosos, conectivopatías, tumores, malformaciones quísticas o en el neumotórax catamenial.
La presencia de aire en el espacio pleural, hace que la presión intrapleural se iguale a la atmosférica, y esto predispone a un colapso pulmonar parcial o completo.
Clínica
La mayoría ocurren en reposo, aunque pueden precipitarse por cualquier maniobra que aumente la presión intratorácica como un Valsalva, y los síntomas principales son: dolor pleurítico, disnea y taquipnea.
La clínica va a depender de: grado de presión intrapleural, extensión del colapso pulmonar, velocidad de instauración y reserva respiratoria del paciente.
En la exploración física, podemos encontrar: menor expansión torácica en el hemitórax afecto, timpanismo, disminución del murmullo vesicular y menor transmisión de las vibraciones vocales. Desde el punto de vista clínico, es importante distinguir entre neumotórax simple y neumotórax a tensión, que es aquel que se produce por un mecanismo valvular que permite la entrada de aire, pero no su salida, y que constituye una urgencia vital, dado que va a producir un compromiso ventilatorio y circulatorio, por disminución del retorno venoso y en consecuencia, del gasto cardiaco.
Diagnóstico
La historia clínica y exploración física nos van a dar un diagnóstico de sospecha, que debe confirmarse con una radiografía de tórax.
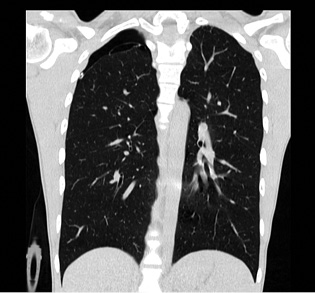
En la proyección póstero-anterior convencional, se identifican la mayoría de los neumotórax; pero para los de pequeño tamaño, es necesaria una radiografía en espiración. En neonatos o pacientes en los que la radiografía se realice en decúbito, puede ser necesaria una proyección lateral. Los hallazgos radiológicos son: hiperclaridad y aumento de volumen en el hemitórax afecto, colapso pulmonar y desplazamiento mediastínico al lado contralateral. Se puede ver también la línea de la pleura visceral (Fig. 3).
Figura 3. Radiografía de tórax posteroanterior en paciente con neumotórax izquierdo.
No existe una forma exacta de determinar el tamaño del neumotórax. Habitualmente, se usan los criterios empleados en adultos para los pacientes adolescentes (neumotórax grande: aquel en el que la línea de la pleura en la Rx se separa >3 cm en el borde apical o >2 cm en el lateral); mientras que para pacientes de menor edad, se define como: aquel que ocupa más de un 30% del tamaño del hemitórax afecto.
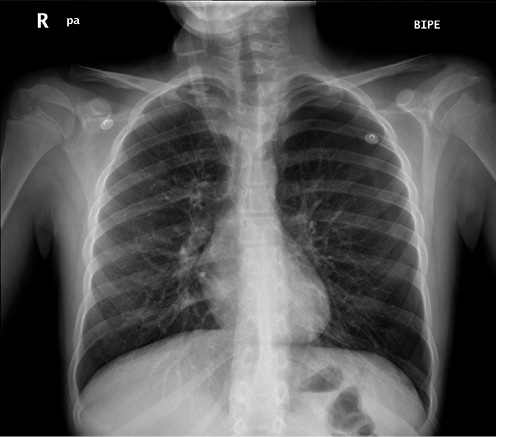
Otras pruebas de imagen como la TAC torácica, no se realizan de rutina y se reservan para pacientes en los que se sospecha alguna lesión subyacente en la radiografía o aquellos casos que precisan tratamiento quirúrgico. Está, por tanto, orientada a identificar lesiones susceptibles de tratamiento, fundamentalmente bullas subpleurales, que es la patología más frecuentemente encontrada en estos pacientes (Fig. 4).
Figura 4. Tomografía axial computarizada torácica en un paciente con fuga persistente, en el que se observa neumotórax y una bulla apical en LSD.
Tratamiento
Dependiendo de la situación clínica del paciente y el tipo de neumotórax, se optará por un tratamiento conservador o intervencionista (toracocentesis y aspiración, colocación de drenaje torácico o cirugía).
No existen guías clínicas específicas del manejo del neumotórax en la población pediátrica, por lo que el tratamiento se hace adaptando las recomendaciones de las guías existentes en adultos.
Tratamiento conservador
En el caso de neumotórax pequeños y en pacientes estables, se puede llevar a cabo una actitud expectante, con observación clínica y repetición de la radiografía en 6-12 horas. Aunque en adultos, se puede realizar tratamiento ambulatorio, en pacientes pediátricos lo habitual es que se lleve a cabo hospitalizados, al menos, durante las primeras 24 horas(19). Aunque en niños no existen estudios concluyentes sobre el papel de la oxigenoterapia suplementaria, dado que en adultos se ha visto que puede favorecer la reabsorción del neumotórax, se suele emplear durante el período de observación clínica, exceptuando los neonatos, en los que únicamente se emplea si tiene requerimientos de oxígeno suplementario y no por un tiempo superior a 72 horas.
Toracocentesis y colocación de drenaje torácico
Está indicado en el caso de pacientes con neumotórax grandes, en aquellos que tienen repercusión clínica, aunque sean de pequeño tamaño y en los que han aumentado durante el período de observación clínica. En el neumotórax espontáneo primario con paciente estable se puede realizar, de inicio, una toracocentesis y aspiración manual, que puede ser tan eficaz como la colocación de un tubo de drenaje, pero dado que en niños el procedimiento habitualmente requiere sedación, siempre que en la misma haya salida de gran cantidad de aire, es preferible dejar colocado un tubo de drenaje(19). La inserción del tubo se realiza en el 5º espacio intercostal línea medio axilar y la tendencia es a colocar catéteres finos, dado que se ha visto que son igual de eficaces que los de mayor diámetro y son mejor tolerados. El drenaje debe conectarse a un sistema de recolección con sello de agua y posibilidad de aspiración manual o digital, que permiten ajustar la presión de aspiración. Inicialmente, no se debe instaurar aspiración para evitar que se produzca edema pulmonar por una reexpansión brusca. Se iniciará aspiración activa en los casos en los que no se consiga reexpandir el pulmón por completo. El drenaje debe mantenerse hasta que hayan pasado 24 horas sin fuga aérea. Antes de retirarlo es recomendable mantenerlo pinzado 6-12 horas y realizar una radiografía de control para comprobar que no hay cámara de aire.
Tratamiento quirúrgico
Las indicaciones de tratamiento quirúrgico en el neumotórax son:
• Fuga aérea persistente, tras 5-7 días de drenaje torácico.
• Recidiva de neumotórax espontáneo primario, ipsilateral o contralateral.
• Hemoneumotórax.
En pacientes con neumotórax espontáneo secundario, es necesario valorar el tipo de patología de base y el número y extensión de las recurrencias, así como la posibilidad de que el tratamiento quirúrgico pueda interferir en un procedimiento futuro (p. ej., trasplante pulmonar en pacientes con fibrosis quística).
En cuanto a las opciones de tratamiento, actualmente la más empleada es la videotoracoscopia, que permite identificar y tratar lesiones pulmonares causantes (fundamentalmente, bullas subpleurales que se resecan en la propia intervención), habitualmente asociada a pleurodesis mecánica mediante abrasión de la pleura parietal. Otra opción de pleurodesis es la química, en la que se emplean sustancias que irritan la pleura (talco, sangre autóloga), pero tienen más complicaciones como la infección, y se reservan para casos en los que fracasa el tratamiento anterior o en pacientes con alto riesgo quirúrgico. La cirugía abierta mediante toracotomía y pleurectomía, en la actualidad, es muy poco usada en pacientes pediátricos.
Función del pediatra de Atención Primaria
Tanto el derrame pleural como el neumotórax son patologías potencialmente graves en la infancia, por lo que se recomienda su valoración hospitalaria. La labor del pediatra de Atención Primaria pasa por tener un alto índice de sospecha en los niños con la sintomatología descrita en el texto de este artículo. Ante cuadros leves sin compromiso clínico, puede solicitarse una radiografía de tórax para confirmar el diagnóstico antes de la derivación al centro hospitalario de referencia. En el resto de casos, se recomienda la derivación urgente para valoración y tratamiento.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1. Lai-Fook SJ. Pleural mechanics and fluid exchange. Physiol Rev. 2004; 84: 385-410.
2.** Tutor JD. Chylothorax in infants and children. Pediatrics. 2014; 133: 722-33.
3. Attar MA, Donn SM. Congenital chylothorax. Semin Fetal Neonatal Med. 2017; 22: 234-9.
4. Wiese AD, Griffin MR, Zhu Y, Mitchel EF Jr, Grijalva CG. Changes in empyema among U.S. children in the pneumococcal conjugate vaccine era. Vaccine. 2016; 34: 6243-9.
5. Picazo JJ, Ruiz-Contreras J, Casado-Flores J, Negreira S, Baquero-Artiago F, Hernández-Sampelayo T, et al. Impact of 13-valent pneumococcal conjugate vaccination on invasive pneumococcal disease in children under 15 years old in Madrid, Spain, 2007 to 2016: The HERACLES clinical surveillance study. Vaccine. 2019; 37: 2200-7.
6.*** Antón-Pacheco Sánchez JL, Luna Paredes MC, Gimeno Díaz de Atauri A. Derrame pleural no paraneumónico, quilotórax, hemotórax y mediastinitis. Protoc diagn ter pediatr. 2017; 1: 211-9.
7.** Andrés Martín A, Asensio de la Cruz O, Pérez Pérez G. Complicaciones de la neumonía adquirida en la comunidad: derrame pleural, neumonía necrotizante, absceso pulmonar y pioneumotórax. Protoc diagn ter pediatr. 2017; 1: 127-46.
8. Balfour-Lynn IM, Abrahamson E, Cohen G, Hartley J, King S, Parikh D, et al. BTS guidelines for the management of pleural infection in children. Thorax. 2005; 60: i1-21.
9.** Calder A, Owens CM. Imaging of parapneumonic pleural effusions and empyema in children. Pediatr Radiol. 2009; 39: 527-37.
10.** Bueno Fischer G, Teresinha Mocelin H, Feijó Andrade C, Sarria EE. When should parapneumonic pleural effusions be drained in children? Paediatr Respir Rev. 2018; 26: 27-30.
11.*** Moreno-Pérez D, Andrés Martín A, Tagarro García A, Escribano Montaner A, Figuerola Mulet J, García García JJ, et al. Neumonía adquirida en la comunidad: tratamiento de los casos complicados y en situaciones especiales. Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP) y Sociedad Española de Neumología Pediátrica (SENP). An Pediatr (Barc). 2015; 83: 217.e1-11.
12. Islam S, Calkins CM, Goldin AB, Chen C, Downard CD, Huang EY, et al. The diagnosis and management of empyema in children: a comprehensive review from the APSA Outcomes and Clinical Trials Committee. J Pediatr Surg. 2012; 47: 2101-10.
13. Bradley JS, Byington CL, Shah SS, Alverson B, Carter ER, Harrison C, et al. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis. 2011; 53: e25-76.
14. Redden MD, Chin TY, van Driel ML. Surgical versus non-surgical management for pleural empyema. Cochrane Database Syst Rev. 2017; 3: CD010651.
15.*** Feola GP, Hogan MJ, Baskin KM, Chahil AM, Connolly BL, Crowlley JJ, et al. Quality Improvement Standards for the Treatment of Pediatric Empyema. J Vasc Interv Radiol. 2018; 29: 1415-22.
16. Sahn SA, Heffner JE. Spontaneus pneumothorax. N Engl J Med. 2000; 342: 868.
17. Weissberg D, Rafaely Y. Pneumothorax: experience with 1199 patients. Chest. 2000; 117: 1279.
18. Robinson PD, Cooper P, Rananathan S. Evidence-based management of paediatric primary spontaneus pneumothorax. Arch Dis Child. 2015; 100: 918-23.
19.** Irastorza IX, Landa J, Gómez P. Neumotórax. An Pediatr. 2003; 58: 30-4.
20.*** Soccorso G, Anbarasan R, Singh M, Lindley RM, Marven SS, Parikh DH. Management of large primary spontaneous pneumothorax in children: radiological guidance, surgical intervention and proposed guideline. Pediatr Surg Int. 2015; 31: 1139-44.
21. Martín de Vicente C. Malformaciones congénitas de las vías respiratorias inferiores. Pediatr Integral. 2016; XX(1): 51-61.
Bibliografía recomendada
- Feola GP, Hogan MJ, Baskin KM, Chahil AM, Connolly BL, Crowlley JJ, et al. Quality Improvement Standards for the Treatment of Pediatric Empyema. J Vasc Interv Radiol. 2018; 29: 1415-22.
Revisión actualizada de la evidencia sobre las principales controversias en el manejo del derrame paraneumónico en niños. Incluye descripción de aspectos técnicos y propuesta de algoritmo de manejo.
- Antón-Pacheco Sánchez JL, Luna Paredes MC, Gimeno Díaz de Atauri A. Derrame pleural no paraneumónico, quilotórax, hemotórax y mediastinitis. Protoc diagn ter pediatr. 2017; 1: 211-9.
Protocolo de la Asociación Española de Pediatría y la Sociedad Española de Neumología Pediátrica, sobre el derrame pleural no paraneumónico. Aporta información añadida sobre el quilotórax o el hemotórax, que no se desarrollan en este artículo.
- Calder A, Owens CM. Imaging of parapneumonic pleural effusions and empyema in children. Pediatr Radiol. 2009; 39: 527-37.
Revisión narrativa sobre el papel de las distintas pruebas de imagen en el derrame paraneumónico.
- Moreno-Pérez D, Andrés Martín A, Tagarro García A, Escribano Montaner A, Figuerola Mulet J, García García JJ, et al. Neumonía adquirida en la comunidad: tratamiento de los casos complicados y en situaciones especiales. Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP) y Sociedad Española de Neumología Pediátrica (SENP). An Pediatr (Barc). 2015; 83: 217.e1-11.
Consenso nacional español entre las sociedades de infectología y neumología pediátricas, sobre el manejo de la neumonía complicada, incluido el derrame paraneumónico.
- Jiménez P, López-Fernández S, Laín A, Burrieza GG, Roca JL. Neumotórax espontáneo en la edad pediátrica: factores asociados a su recidiva. Cir Pediatr. 2015; 28: 200-14.
Estudio retrospectivo de pacientes con neumotórax, que han precisado tratamiento con la finalidad de analizar factores que predispongan a la recidiva.
- Aguinagalde B, Aranda JL, Busca P, Martínez I, Royo I, Zabaleta J, et al. Guía de práctica clínica de la SECT sobre el manejo de pacientes con neumotórax espontaneo. Cir esp. 2018; 96: 3-11.
Guía de práctica clínica para el manejo de pacientes con neumotórax. Aunque se describe para pacientes adultos, su lectura resulta de utilidad dada la escasez de guías específicas para pacientes pediátricos.
| Caso clínico |
|
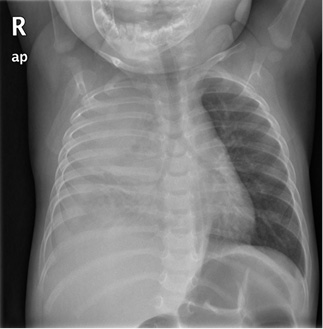
Anamnesis Lactante de 9 meses, correctamente vacunado para su edad, sin antecedentes patológicos relevantes, que acude a urgencias por un cuadro clínico de: fiebre de hasta 39ºC, irritabilidad, rechazo de las tomas y quejido intermitente de 3 días de evolución, con empeoramiento en las últimas 24 horas. Tos y rinorrea sin otra sintomatología acompañante. Exploración física SatO2: 94%. FC: 135 lpm. Aceptable estado general, algo decaído. Reactivo. Bien nutrido, hidratado y perfundido. Relleno capilar inmediato. No lesiones en piel. Buena perfusión periférica. Quejido respiratorio, tiraje inter y subcostal leve, con hipoventilación en hemitórax derecho a la auscultación pulmonar. Auscultación cardíaca rítmica y sin soplos. Sin otros hallazgos patológicos. Pruebas complementarias – Laboratorio: destaca leucocitosis (21.400/μl, neutrófilos 19.300 μl) y elevación de reactantes de fase aguda (proteína C reactiva. 29,5 mg/dl; procalcitonina 18,53 ng/ml). – Radiografía de tórax (Fig. 5).
Figura 5. Radiografía de tórax
|





 Persistent cough
Persistent cough 